Pilas y Acumuladores sus diferencias
Introducción
Pila eléctrica: dispositivo que convierte la energía química en eléctrica.
Todas las pilas consisten en un electrolito (que puede ser líquido, sólido o en pasta).un electrodo positivo y un electrodo negativo. El electrolito es un conductor iónico; uno de los electrodos produce electrones y el otro electrodo los recibe. Al conectar los electrodos al circuito que hay que alimentar, se produce una corriente eléctrica.
Las pilas en las que el producto químico no puede volver a su forma original una vez que la energía química se ha transformado en energía eléctrica (es decir, cuando las pilas se han descargado), se llaman pilas primarias o voltaicas. Las pilas secundarias o acumuladores son aquellas pilas reversibles en las que el producto químico que al reaccionar en los electrodos produce energía eléctrica, puede ser reconstituido pasando una corriente eléctrica a través de él en sentido opuesto a la operación normal de la pila.
Pilas primarias
La pila primaria más común es la pila Leclanché o pila seca, inventada por el químico francés Georges Leclanché en la década de 1860. La pila seca que se utiliza hoy es muy similar al invento original. El electrolito es una pasta consistente en una mezcla de cloruro de amonio y cloruro de cinc. El electrodo negativo es de cinc, igual que el recipiente de la pila, y el electrodo positivo es una varilla de carbono rodeada por una mezcla de carbono y dióxido de manganeso. Esta pila produce una fuerza electromotriz de unos 1,5 voltios.
Otra pila primaria muy utilizada es la pila de cinc-óxido de mercurio, conocida normalmente como batería de mercurio. Puede tener forma de disco pequeño y se utiliza en audífonos, células fotoeléctricas y relojes de pulsera eléctricos. El electrodo negativo es de cinc, el electrodo positivo de óxido de mercurio y el electrólito es una disolución de hidróxido de potasio. La batería de mercurio produce 1,34 V, aproximadamente.
La pila de combustible es otro tipo de pila primaria. Se diferencia de las demás en que los productos químicos no están dentro de la pila, sino que se suministran desde fuera.
Como funciona una pila
Una pila es un dispositivo capaz de generar electricidad a partir de una reacción química. Esta corriente es continua, y no alterna como la que hay en los enchufes de nuestras viviendas.
Veamos los diferentes tipos de pilas y sus reacciones químicas:
Pilas salinas (Leclanché):
- f.e.m.: 1.5 V
- Difícilmente regenerable (no recargable)
- No permite altas intensidades de corriente

Pilas alcalinas (Mallory):
- f.e.m.: 1.5 V
- Mayor potencia y duración

Pilas de mercurio (de botón):
- f.e.m.: 1.35 V
- Voltaje más constante
- Larga duración

Pilas de plata:
- f.e.m.: 1.55 V
- Similar a las de mercurio, pero el cátodo es de óxido de plata (Ag2O)
- Mucho más caras
Pilas de Litio:
- f.e.m.: 3-3.5 V
- Fácilmente recargables.
- Muy larga duración
Acumulador de plomo (Gastón Planté, 1859):
- f.e.m.: 2V
- Grandes y pesadas
- Baratas
- Uso de ácido sulfúrico diluido

PILAS SOLARES
Las pilas solares producen electricidad por un proceso de conversión fotoeléctrica. La fuente de electricidad es una sustancia semiconductora fotosensible, como un cristal de silicio al que se le han añadido impurezas. Cuando la luz incide contra el cristal, los electrones se liberan de la superficie de éste y se dirigen a la superficie opuesta. Allí se recogen como corriente eléctrica. Las pilas solares tienen una vida muy larga y se utilizan sobre todo en los aviones, como fuente de electricidad para el equipo de a bordo.
Las baterías de almacenamiento o acumuladores consisten en conjuntos de células secundarias. Mientras una célula primaria depende de un consumo irreversible de sus partes componentes, una célula secundaria puede agotarse por descarga, y luego volver al estado de carga integral si se hace circular una corriente continua o directa a través de ella en dirección contraria a la de la descarga. Este proceso puede repetirse centenares de veces antes de que la batería se gaste. La batería de un automóvil está constituida por un conjunto de acumuladores de plomo. Cada uno contiene dos placas de plomo que adoptan la forma de rejillas para aumentar el área superficial. Los orificios de la rejilla negativa se llenan con plomo esponjoso; los de la rejilla positiva con bióxido de plomo. El conjunto de células secundarias formadas por una serie de placas alternadas de plomo y bióxido de plomo, se sumergen en una solución de ácido sulfúrico en agua destilada. Tanto el plomo como el bióxido de plomo reaccionan con el ácido sulfúrico y forman sulfato de plomo y agua. Se liberan iones de hidrógeno positivo y iones de sulfato negativos. El sulfato de plomo resulta prácticamente insoluble en el electrólito, y forma un depósito blanco sobre las placas. Cuando ambos conjuntos de placas están cubiertos, la batería se ha agotado, o está descargada, porque ya no hay diferencia de potencial entre las placas. Cuando una corriente continua externa se conecta con las placas para recargarlas, los iones de hidrógeno emigran a las placas negativas y los iones de sulfato a las positivas. Vuelve a formarse plomo esponjoso en las placas negativas, y bióxido de plomo en las positivas. Si la batería recargada se conecta, por ejemplo con el circuito de un automóvil, comienza a descargarse. Es decir, suministra electricidad al circuito hasta que nuevamente se descarga. El voltaje nominal de una célula de plomo es aproximadamente de dos voltios, y una batería de automóvil generalmente consiste en seis células conectadas en serie, de modo que se obtienen doce voltios en las terminales de la batería.
Hay también células secundarias alcalinas, que tienen un electrólito de hidróxido de potasio diluido y una placa positiva de hidrato de níquel. La placa negativa puede ser hierro o cadmio. Un artefacto que se aplica particularmente a los vehículos eléctricos es la batería de aire y cinc. Aunque se trata de una batería primaria, puede recargarse sustituyendo el electrodo de cinc cuando éste se agotó y se convirtió en óxido de cinc.
Otra forma interesante con relación a la aplicación de energía motriz está constituida por la célula a combustible o pila de gas.
La electricidad se genera directamente mediante reacciones químicas, por ejemplo, combinación de oxígeno con hidrógeno en presencia de electrodos adecuados, con formación de agua. Como esta sustancia es importante para los astronautas, tales pilas se han utilizado en satélites artificiales.
Carga y descarga en el acumulador plomo-ácido
Analizaremos los fenómenos químicos en un acumulador plomo-ácido. Cuando está totalmente cargado, las placas negativas (electrodos) son de plomo y las positivas de peróxido. El electróIito es ácido sulfúrico y agua. Si conectamos un conductor entre el terminal positivo y el negativo, circula corriente y la pila comienza a descargarse. Durante la descarga disminuye el contenido de ácido del electrólito y se deposita sulfato de plomo (PbSO4) sobre ambas placas, positiva y negativa. Aumenta por lo tanto la cantidad de agua. Este proceso continúa hasta que ambos electrodos contienen un máximo de sulfato de plomo y la densidad del electrólito es muy baja. Al llegar a ese punto, dado que ambos electrodos no son dilerentes, f.e.m. entre ellos es mínima.

Ciclo de carga y descarga de un acumulador del tipo ácido.
El acumulador puede ser recargado invirtiendo la dirección de la corriente de descarga. Esto se hace conectando el terminal positivo de la batería al terminal positivo del cargador de baterías. Durante el proceso de carga la placa negativa retorna al plomo y la positiva al perióxido. El sulfato retorna ai electrólito y aumenta la densidad de éste. Durante la carga, se desprende hidrógeno y oxígeno, y se debe agregar algo de agua al electrólito para reemplazar la que se ha perdido. Esta es la razón por la cual se agrega agua a la hatería del automóvil dos o tres veces al año.
DIFERENCIAS
Los acumuladores más comunes son los de Plomo-ácido, empleados en automóviles antiguos ó en sistemas fotovoltaicos aislados. En ellos hay electrodos de Plomo en un electrolito compuesto de ácido sulfurico diluido en agua.
Otros acumuladores son los de metal-hidrudo (MH), más caros pero mejores. Estos últimos se emplean en baterías de coche y pilas recargables, entre otros.
La diferencia principal entre la pila primaria y la secundaria, es que esta última es recargable. Esto significa que luego que ha estado en uso y se ha descargado, se puede invertir su acción química y la pila se recarga. La más popular y ampliamente usada de las pilas secundarias, es el acumulador plomo-ácido, para automóviles. Cuando está totalmente cargado, este acumulador tiene un voltaje de salida aproximado de 2,2 volts. Las baterías para automóviles generalmente contienen tres o seis de estos elementos. La pila plomo-ácido es capaz de dar corriente extremadamente alta, de varios cientos de amperios.
Los dos metales distintos de la pila plomo-ácido son plomo (Pb) en forma de una placa formada por metal finamente dividido, y perióxido de.plomo (PbO2). El plomo es el electrodo negativo y el peróxido el positivo. Estos materiales son relativamente blandos y se pasan por las aberturas de una rejilla que forma una placa corrugada. El electrólito es ácido sulfúrico (H2SO4) mezclado con agua destilada (H2O). Una pila está formada por varias placas negativas y positivas, unidas y contenidas dentro de un recipiente, junto con el electrólito. Las condiciones en que se halla la pila puede ser medida con un densímetro, que determina la gravedad específica del electrólito (peso del electrólito comparado con el peso del agua). Cuando está totalmente cargada, su densidad puede ser de 1,25; cuando está descargada de 1,1.
Las pilas y el ambiente
Los metales y productos químicos constituyentes de las pilas pueden resultar perjudiciales para el medio ambiente, produciendo contaminación química. Es muy importante no tirarlas a la basura (en algunos países no está permitido), sino llevarlas a centros de reciclado. En algunos países, la mayoría de los proveedores y tiendas especializadas también se hacen cargo de las pilas gastadas. Una vez que la envoltura metálica que recubre las pilas se daña, las sustancias químicas que contienen se ven liberadas al medio ambiente causando contaminación. Con mayor o menor grado, las sustancias son absorbidas por la tierra pudiéndose filtrar hacia los mantos acuíferos y de éstos pueden pasar directamente a los seres vivos, entrando con esto en la cadena alimenticia.
Estudios especializados indican que una micro pila de mercurio, puede llegar a contaminar
Las pilas son residuos peligrosos por lo que desde el momento en que se empiezan a reunir, deben ser manejadas por personal capacitado que siga las precauciones adecuadas empleando todos los procedimientos técnicos y legales del manejo de residuos peligrosos.
Corrosion y Anticorrosivos
Introducción
También se pretende enfocar diferentes puntos de vista sobre un tema que es de vital importancia en el mundo de hoy en día, por su efecto en equipos, herramientas, maquinarias y estructuras.
Se plantearan las soluciones que existen para detener la corrosión como los son los llamados anticorrosivos
Corrosión en un ancla.
Corrosión y Anticorrosivos.
 Se entiende por corrosión la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. Las características fundamental de este fenómeno, es que sólo ocurre en presencia de un electrólito, ocasionando regiones plenamente identificadas, llamadas estas anódicas y catódicas: una reacción de oxidación es una reacción anódica, en la cual los electrones son liberados dirigiéndose a otras regiones catódicas. En la región anódica se producirá la disolución del metal (corrosión) y, consecuentemente en la región catódica la inmunidad del metal.
Se entiende por corrosión la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. Las características fundamental de este fenómeno, es que sólo ocurre en presencia de un electrólito, ocasionando regiones plenamente identificadas, llamadas estas anódicas y catódicas: una reacción de oxidación es una reacción anódica, en la cual los electrones son liberados dirigiéndose a otras regiones catódicas. En la región anódica se producirá la disolución del metal (corrosión) y, consecuentemente en la región catódica la inmunidad del metal.
Los enlaces metálicos tienden a convertirse en enlaces iónicos, los favorece que el material puede en cierto momento transferir y recibir electrones, creando zonas catódicas y zonas anódicas en su estructura. La velocidad a que un material se corroe es lenta y continua todo dependiendo del ambiente donde se encuentre, a medida que pasa el tiempo se va creando una capa fina de material en la superficie, que van formándose inicialmente como manchas hasta que llegan a aparecer imperfecciones en la superficie del metal.
Este mecanismo que es analizado desde un punto de vista termodinámico electroquímico, indica que el metal tiende a retornar al estado primitivo o de mínima energía, siendo la corrosión por lo tanto la causante de grandes perjuicios económicos en instalaciones enterradas. Por esta razón, es necesario la oportuna utilización de la técnica de protección catódica.
Se designa químicamente corrosión por suelos, a los procesos de degradación que son observados en estructuras enterradas. La intensidad dependerá de varios factores tales como el contenido de humedad, composición química, pH del suelo, etc. En la práctica suele utilizarse comúnmente el valor de la resistividad eléctrica del suelo como índice de su agresividad; por ejemplo un terreno muy agresivo, caracterizado por presencia de iones tales como cloruros, tendrán resistividades bajas, por la alta facilidad de transportación iónica.
La protección catódica es un método electroquímico cada vez más utilizado hoy en día, el cual aprovecha el mismo principio electroquímico de la corrosión, transportando un gran catódo a una estructura metálica, ya sea que se encuentre enterrada o sumergida. Para este fin será necesario la utilización de fuentes de energía externa mediante el empleo de ánodos galvánicos, que difunden la corriente suministrada por un transformador-rectificador de corriente.
El mecanismo, consecuentemente implicará una migración de electrones hacia el metal a proteger, los mismos que viajarán desde ánodos externos que estarán ubicados en sitios plenamente identificados, cumpliendo así su función.
A está protección se debe agregar la ofrecida por los revestimientos, como por ejemplo las pinturas, casí la totalidad de los revestimientos utilizados en instalaciones enterradas, aéreas o sumergidas, son pinturas industriales de origen orgánico, pues el diseño mediante ánodo galvánico requiere del cálculo de algunos parámetros, que son importantes para proteger estos materiales, como son: la corriente eléctrica de protección necesaria, la resistividad eléctrica del medio electrólito, la densidad de corriente, el número de ánodos y la resistencia eléctrica que finalmente ejercen influencia en los resultados.
Aproximación a la corrosión de los metales

Esquema de oxidación del hierro, ejemplo de corrosión del tipo polarizada.
La corrosión de los metales es un fenómeno natural que ocurre debido a la inestabilidad termodinámica de la mayoría de los metales. En efecto, salvo raras excepciones (el oro, el hierro de origen meteorítico) los metales están presentes en
A menudo se habla del acero inoxidable; el término es impropio por dos razones:
- este tipo de acero contiene elementos de aleación (cromo, níquel) que se oxidan; a esta capa de óxido se debe la protección del acero;
- no está protegido más que en ciertos tipos de ambiente, y se corroerá en ambientes distintos.
Existen múltiples variedades de aceros llamados "inoxidables", que llevan nombres como "304", "304L", "316N", etc. correspondientes a distintas composiciones y tratamientos. Cada acero corresponde a ciertos tipos de ambiente; su uso en ambientes distintos será catastrófico.
Además, el material del que está hecha la pieza no es el único parámetro. La forma de la pieza y los tratamientos a los que se la somete (conformación, soldadura, atornillado) tienen un papel primordial. Así, un montaje de dos metales diferentes (por ejemplo, dos variedades de acero, o el mismo acero con tratamientos diferentes)puede dar pie a una corrosión acelerada; además, a menudo se ven trazas de herrumbre en las tuercas. Asimismo, si la pieza presenta un intersticio (por ejemplo, entre dos placas), ahí puede formarse un medio confinado que evolucionará de un modo diferente del resto de la pieza y, por lo tanto, podrá llegar a una corrosión local acelerada. De hecho, toda heterogeneidad puede desembocar en una corrosión local acelerada, como, por ejemplo, en los cordones de soldadura o en la mano al ser salpicada por un ácido.
Tipos de corrosión
Existen muchos mecanismos por los cuales se verifica la corrosión, que tal como se ha explicado anteriormente es fundamentalmente un proceso electroquímico.
Corrosión electroquímica o polarizada
La corrosión electroquímica se establece cuando en una misma superficie metálica ocurre una diferencia de potencial en zonas muy próximas entre si en donde se establece una migración electrónica desde aquella en que se verifica el potencial de oxidación más elevado, llamado área anódica hacia aquella donde se verifica el potencial de oxidación(este término ha quedado obsoleto, actualmente se estipula como potencial de reducción) más bajo, llamado área catódica.
El conjunto de las dos semi reacciones constituye una célula de corrosión electroquímica.
Corrosión por oxígeno
Este tipo de corrosión ocurre generalmente en superficies expuestas al oxígeno diatómico disuelto en agua o al aire, se ve favorecido por altas temperaturas y presión elevada ( ejemplo: calderas de vapor). La corrosión en las máquinas térmicas (calderas de vapor) representa una constante pérdida de rendimiento y vida útil de la instalación.
Corrosión microbiológica
Es uno de los tipos de corrosión electroquímica. Algunos microganismos son capaces de causar corrosión en las superficies metálicas sumergidas. Se han identificado algunas especies hidrógeno dependientes que usan el hidrógeno disuelto del agua en sus procesos metabólicos provocando una diferencia de potencial del medio circundante. Su accionar está asociado al pitting (picado) del oxígeno o la presencia de ácido sulfhídrico en el medio. En este caso se clasifican las ferrobacterias.
Corrosión por presiones parciales de oxígeno
El oxígeno presente en una tubería por ejemplo, está expuesto a diferentes presiones parciales del mismo. Es decir una superficie es más aireada que otra próxima a ella y se forma una pila. El área sujeta a menor aireación (menor presión parcial) actúa como ánodo y la que tiene mayor presencia de oxígeno (mayor presión) actúa como un cátodo y se establece la migración de electrones, formándose óxido en una y reduciéndose en la otra parte de la pila. Este tipo de corrosión es común en superficies muy irregulares donde se producen obturaciones de oxígeno.
Corrosión por actividad salina diferenciada
Este tipo de corrosión se verifica principalmente en calderas de vapor, en donde la superficie metálica expuesta a diferentes concentraciones salinas forman a ratos una pila galvánica en donde la superficie expuesta a la menor concentración salina se comporta como un ánodo.
Un material anticorrosivo es un material que sirve para proteger una superficie de un proceso de degradación llamado corrosión. La corrosión es un proceso electroquímico complejo y difícil de controlar.
La pintura para metales tiene como principal razón evitar su corrosión. En el mundo se gastan cantidades impresionantes en el control de la corrosión, pues sin control se caerían los puentes, las montañas rusas, los semáforos, los autos, etc. se destruirían, ya que todos se degradarían paulatinamente sin una pintura que los recubra.
El proceso de evitar la corrosión de manera más efectiva compete a las técnicas de modificación de superficie.
Proteccion contra la corrosion
La corrosión es, pues, un fenómeno que depende del material utilizado, de la concepción de la pieza (forma, tratamiento, montaje) y del ambiente. Se puede influir entonces en estos tres parámetros; se puede influir también en la reacción química misma.
Elección del material
La primera idea es escoger todo un material que no se corroa en el ambiente considerado. Se pueden utilizar aceros inoxidables, aluminios, cerámicas, polímeros (plásticos), etc. La elección también debe tomar en cuenta las restricciones de la aplicación (masa de la pieza, resistencia a la deformación, al calor, capacidad de conducir la electricidad, etc.).
Cabe recordar que no existen materiales absolutamente inoxidables; hasta el aluminio se puede corroer.
Concepción de la pieza
En la concepción, hay que evitar las zonas de confinamiento, los contactos entre materiales diferentes y las heterogeneidades en general.
Hay que prever también la importancia de la corrosión y el tiempo en el que habrá que cambiar la pieza (mantenimiento preventivo).
Dominio del ambiente
Cuando se trabaja en ambiente cerrado (por ejemplo, un circuito cerrado de agua), se pueden dominar los parámetros que influyen en la corrosión; composición química (particularmente la acidez), temperatura, presión... Se puede, v.g., agregar productos llamados "inhibidores de corrosión". Un inhibidor de corrosión es una sustancia que, añadida a un determinado medio, reduce de manera significativa la velocidad de corrosión. Las substancias utilizadas dependen tanto del metal a proteger como del medio, y un inhibidor que funciona bien en un determinado sistema puede incluso acelerar la corrosión en otro sistema.
Sin embargo, este tipo de solución es inaplicable cuando se trabaja en medio abierto (atmósfera, mar, cuenca en contacto con el medio natural, circuito abierto, etc.)
Inhibidores de la corrosión
Los inhibidores de corrosión, son productos que actúan ya sea formando películas sobre la superficie metálica, tales como los molibdatos o fosfatos, o bien entregando sus electrones al medio. Por lo general los inhibidores de este tipo son azoles modificados que actúan sinérgicamente con otros inhibidores tales como nitritos, fosfatos y silicatos. La química de los inhibidores no está del todo desarrollada aun. Su uso es en el campo de los sistemas de enfriamiento o disipadores de calor tales como los radiadores, torres de enfriamiento, calderas y "chillers".
Aislamiento del medio
Existen distintos medios para impedir que ocurra la reacción química. Como primera medida de protección se puede aislar la pieza del ambiente, dándole una mano de pintura, cubriendo la pieza de plástico, haciendo un tratamiento de superficie (por ejemplo, nitruración, cromatación o proyección plasma).
Galvanismo anódico o protección catódica
También se puede introducir otra pieza para perturbar la reacción; es el principio del "ánodo de sacrificio" o "protección galvánica". Se coloca una pieza de aleaciones de zinc, aleaciones de magnesio y aleaciones de aluminio, que se van a corroer en lugar de la pieza que se quiere proteger; la reacción química entre el ambiente y la pieza sacrificada impide la reacción entre el ambiente y la pieza útil. En medio acuoso, basta con atornillar el ánodo de sacrificio a la pieza que se debe proteger. Al aire, hay que recubrir totalmente la pieza; es el principio de la galvanización. Este método se usa ampliamente en
Galvanoplastia
La pieza se puede recubrir con una película de otro metal electrodepositado cuyo potencial de reducción es más estable que el alma de la pieza. Galvanoplastia existe como el niquelado, el zincado (galvanizado), el cobrizado y el cromatizado.
El cromado usado comúnmente en la industria automotriz y en la de los fittings confiere una protección estable al alma de hierro con la cual se confecciona el artículo. El cromado (no confundir el cromado, un depósito de cromo, con la cromatación, que es la formación de una capa de metal combinado con iones de cromo VI). En efecto, el cromo mismo no se corroe, protegiendo así la pieza, pero la mínima rayadura es catastrófica, pues la pieza hace entonces las veces de ánodo sacrificial del cromo y se corroe a gran velocidad.
Las pinturas anticorrosión con plomo han sido abandonadas a causa de su impacto dramático en el ambiente.
Aplicación de inhibidores asociados a una película de fijación
En este caso, caen las pinturas anticorrosivas cuyas formulaciones aparte de aportar con un film de aislamiento de tipo epóxico fenólico o epoxi-ureico llevan asociados un paquete anticorrosivo compuesto por moléculas orgánicas o minerales aceptoras de eletrones tales como los azoles.
Es también conveniente mencionar que un inhibidor de corrosión deberá especificarse sobre que tipo de corrosión va a inhibir dado la gran diversidad de tipos y formas de corrosión dependiendo principalmente de las condiciones del medio donde se está llevando a cabo esta.
Exposición a soluciones reductoras
La superficie es expuesta a la permanente exposición de elementos químicos disueltos en una solución a bajas concentraciones, dichas especies son pares reductores que se oxidan ellos mismos a cambio de la pieza y además contribuyen con la pasivación o inactivación de la superficie formando micropelículas químicas estables. Estas especies se encuentran comúnmente en anticongelantes, pinturas base acuosa y otras aplicaciones.
Conclusión
Como conclusión tenemos los siguientes puntos:
· El proceso de corrosion debe ser visto como un hecho que pone en evidencia el proceso natural de que los metales vuelven a su condicion primitiva y lo cual lleva al deterioro de este. No obstante este proceso provoca la investigación y planteamiento de formulas y maneras de alargar la vida útil de los materiales que les ocurre este proceso
· En el trabajo se confirma que la lucha y control de la corrosión es un arte dentro del mantenimiento y que esta área es bastante amplia, dado el sinnúmero de condiciones a los cuales se encuentran sometidos los metales que forman equipos y herramientas.
· Los anticorrosivos son de vital importancia para el funcionamiento de puentes, estructuras metálicas etc.…, ya que, sin ellos estos se derrumbarían por la acción de la corrosion.
Procesos Electrolitos en la Mineria
Procesos redox involucrados en
a) El Cobre: Es un metal muy importante en la industria eléctrica. Es un buen conductor de la electricidad, por lo cual se utiliza en la fabricación de alambres, motores y generadores. El cobre, además, es resistente a la corrosión y, en aleación con el zinc, forma el latón y con estaño el bronce, dos aleaciones de gran utilidad.
El procedimiento empleado para obtener el cobre en
El tratamiento que se aplica para el mineral oxidado se llama lixiviación. Los grandes pedazos del mineral se reducen, por medio de chancadoras, a trozos de poco más de
El tratamiento que sigue el mineral sulfurado se denomina flotación. Lo mismo que para el mineral oxidado, el proceso comienza con la reducción del tamaño del mineral, seguido de una nueva trituración por la llamada vía húmeda a fin de pulverizarlo. El cobre reducido a partículas muy pequeñas se somete al proceso de flotación, con el objetivo de concentrarlo. Para esto se agregan reactivos como aceites minerales o detergentes, haciéndolo pasar luego a las llamadas celdas de flotación, unos depósitos que permiten que el mineral de cobre flote en forma de espuma por un sistema de agitación y aire comprimido.
Después de repetir este proceso se logra un concentrado de entre 35-40% de cobre y 1% de molibdeno, el cual se somete a una flotación diferencial que separa el molibdeno del cobre. La molibdenita una vez secada y tostada en una planta térmica (proceso denominado tostación), se transforma en óxido de molibdeno, que se comercializa.
Para obtener el cobre se sigue un estricto tratamiento de purificación. El mineral concentrado por flotación es conducido a espesadores y filtros que le quitan el agua hasta convertirlo en un polvo negro que después se calienta y funde a
blíster, con un 99% de pureza, según la siguiente ecuación:
Finalmente éste se vierte en moldes donde es refinado electrolíticamente. Mientras más puro es el cobre, tiene mayor capacidad conductiva, que ayuda a la producción industrial.
En la celda electrolítica que se utiliza para la refinación, el cátodo es de cobre de alta pureza y el ánodo, de cobre impuro. El cobre sin purificar contiene metales nobles como el oro y la plata. El medio electrolítico de la celda es una disolución ácida de sulfato de cobre. El procedimiento involucra la oxidación del cobre anódico a ión Cu+2 y la reducción de los iones cúpricos, en el cátodo, según la siguientes semi ecuaciones:
Semi ecuación de oxidación (ánodo): Cu ----> Cu+2 + 2e-
![]() Semi ecuación de reducción (cátodo): Cu+2 + 2e- ----> Cu
Semi ecuación de reducción (cátodo): Cu+2 + 2e- ----> Cu

![]() Ecuación Global: Cu (ánodo) ----> Cu (cátodo)
Ecuación Global: Cu (ánodo) ----> Cu (cátodo)
b) El hierro: Además del cobre, el hierro es otro valioso metal que se produce en nuestro país en gran cantidad. Los principales yacimientos se encuentran en
La obtención del hierro se inicia con la extracción en la mina pasando luego a una etapa de molienda y clasificación. El alto horno es un reactor de varias decenas de metros de altura, en el que se producen una serie de reacciones hasta lograr hierro metálico.
El mineral de hierro , carbón de coque y piedra caliza se cargan por la parte superior del alto horno. Por la parte inferior, se inyecta aire caliente para facilitar los procesos químicos. Las principales reacciones químicas que ocurren en el alto horno son: la generación de gases reductores, la reducción de los óxidos de hierro y la formación de escorias.
![]() 2C(s) + O2(g) ----> 2CO(g)
2C(s) + O2(g) ----> 2CO(g)
A estas altas temperaturas, cualquier formación de CO2 es reducida por las capas superiores de coque, según:
 C(s) + CO2(g) 2CO(g)
C(s) + CO2(g) 2CO(g)
El vapor de agua presente en los gases inytectados reacciona también con el coke, de acuerdo a la siguiente ecuación:
![]() C(s) + H2O(g) ----> CO(g) + H2(g)
C(s) + H2O(g) ----> CO(g) + H2(g)
Los óxidos de hierro son reducidos por el H2(g) y el CO(g) obteniéndose hierro fundido, según:
![]() Fe2O3(s) + 3 CO(g) -----> 2Fe(l) + 3CO2(g)
Fe2O3(s) + 3 CO(g) -----> 2Fe(l) + 3CO2(g)
![]() Fe2O3(s) + 3H2(g) -----> 2Fe(l) + 3H2O(g)
Fe2O3(s) + 3H2(g) -----> 2Fe(l) + 3H2O(g)
La piedra caliza agregada al alto horno participa en la formación de escorias. Con las altas temperaturas, esta se descompone en óxido de calcio y dióxido de carbono, de acuerdo a la siguiente ecuación:
![]() CaCO3(s) -----> CaO(s) + CO2(g)
CaCO3(s) -----> CaO(s) + CO2(g)
El óxido de calcio reacciona con las impurezas que acompañan al mineral. Por ejemplo, con el óxido de sicilio para formar la escoria, principalmente silicato de calcio (CaSiO3), según vemos en la ecuación que sigue:
![]() CaO(s) + SiO2(s) -----> CaSiO3
CaO(s) + SiO2(s) -----> CaSiO3
El silicato de hierro es menos denso que el hierro fundido, por lo que se acumula en la base del horno formando una capa sobre el metal que lo protege de reacciones con el aire. Cada cierto tiempo, se remueve para ser aprovechado en otros procesos.
Las escorias son usadas para fabricar cemento y para hacer carreteras. El hierro fundido se extrae por las salidas laterales situadas en la base del horno. El metal obtenido se contiene alrededor de un 95% de hierro y el 5% restante se compone de impurezas como C,P,Mn y Si. La principal utilidad del hierro es la fabricación del acero, una aleación de hierro y carbono.
Usos de las reacciones Redox en Medicina
Corazón artificial
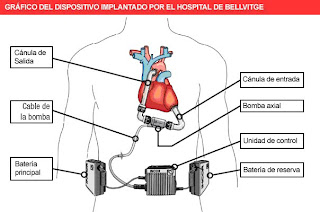
Es a dispositivo prostético eso se implanta en el cuerpo para sustituir el biológico corazón. Es distinto de a puente cardiopulmonar la máquina (CPB), que es un dispositivo externo proporcionaba las funciones del corazón y pulmones. El CPB oxigena la sangre, y por lo tanto no necesita ser conectado con ambos circuitos de la sangre. También, un CPB es conveniente solamente para el uso de algunas horas, mientras que los corazones artificiales se han utilizado por períodos más de largo que un año (en fecha 2007).
Corazón artificial total (TAH) la implantación implica el retiro del corazón nativo. Es un procedimiento quirúrgico similar al trasplante del corazón con un corazón dispensador de aceite humano.
Dispositivos cardiacos de la ayuda (del corazón) diferencie, en que el corazón del paciente no está quitado durante la implantación. Los dispositivos de la ayuda pueden incluir cualquiera a Dispositivo ventricular izquierdo de la ayuda (LVAD) o a Dispositivo ventricular derecho de la ayuda (RVAD) o ambos. En comparación con la implantación de TAH, el dispositivo de la ayuda sirve para proporcionar solamente una parte del volumen cardiaco total del corazón del paciente.
Orígenes
Un reemplazo sintético para el corazón sigue siendo uno de largo-buscado grails santos de la medicina moderna. La ventaja obvia de un corazón artificial funcional sería bajar la necesidad de trasplantes del corazón, porque la demanda para los corazones dispensadores de aceite (mientras que está para todos los órganos) excede siempre grandemente la fuente.
Aunque el corazón es conceptual simple (básicamente a músculo eso funciona como una bomba), incorpora las delicadezas que desafían la emulación directa con los materiales y las fuentes de alimentación sintéticos. Las consecuencias de estas ediciones incluyen severo rechazamiento del extranjero-cuerpo y baterías externas que limitan movilidad paciente. Estas complicaciones limitaron la esperanza de vida de recipientes humanos tempranos a las horas o a los días.
Primer uso clínico de una bomba paracorporeal
El Dr. Michael E. DeBakey y en el su Dr. adecuado. Domingo Liotta, durante la implantación clínica de un dispositivo asistido corpóreo de Párrafos Cardiocirculatory, en el hospital Methodist, Houston, Tejas, los E.E.U.U.
Por la tarde de 21 de abril, 1966 Michael DeBakey y Domingo Liotta implantaron el primer LVAD clínico en una posición paracorporeal (la bomba externa se reclina en el lado del paciente) en el hospital Methodist en Houston en un paciente con choque cardiogenic después de cirugía del corazón. Las complicaciones neurológicas y pulmonares desarrolladas paciente y muerto después de pocos días de la ayuda mecánica de LVAD. En octubre de 1966 Michael E. DeBakey y Domingo Liotta implantó el Liotta-DeBakey paracorporeal LVAD en un nuevo paciente que se recuperó bien, y fue descargado de hospital después de 10 días de ayuda mecánica. así constituyendo el primer uso acertado de un LVAD para el choque postcardiotomy.
Primera implantación clínica de un corazón artificial total
Por la tarde de 4 de abril, 1969 Denton A. Cooley y Domingo Liotta substituyó el corazón de un hombre que moría por un corazón mecánico dentro del pecho en el instituto del corazón de Tejas en Houston como puente para un trasplante. El paciente despertó y se recuperó bien. Después de 64 horas el corazón artificial accionado neumático fue quitado y substituido por un corazón dispensador de aceite. Substituir el corazón artificial demostró ser una mala decisión. Sin embargo, thirty-two horas después del trasplante que el paciente murió de qué fue demostrado más adelante ser una infección pulmonar aguda, ampliada a ambos pulmones, causados por los hongos, causado muy probablemente por una complicación inmunosupresiva de las drogas. Si dejaran el corazón artificial en lugar el paciente no habría muerto
.
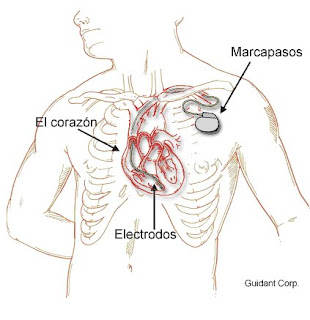
El Marcapaso
El marcapaso es un equipo electrónico que se implanta en el paciente por medio de una cirugía ambulatoria la mayor parte de las veces. El marcapaso se compone de 2 cables (en ocasiones de 1 sólo cable) y un generador de impulsos eléctricos. El marcapaso envía impulsos eléctricos, provocando que el corazón pueda latir a un ritmo establecido. En el interior del generador de impulsos hay un chip electrónico que percibe los latidos del corazón y luego envía las señales necesarias para mantener un ritmo cardíaco normal. Los modelos de marcapaso más modernos que hay en el mercado pesan menos de una onza y son bien delgados. El marcapaso se debe reemplazar cuando se desgaste la batería que generalmente es cada 6-10 años. Los cables van desde el generador de impulso por el interior de los vasos sanguíneos hasta el músculo del corazón. Estos perciben la rapidez con el corazón lleva a cabo el latido y envían la información al generador de impulsos. De acuerdo con la información que es recibida en el generador de impulso se produce o no el impulso eléctrico para estimular el latido.
Un marcapasos moderno tiene una vida estimada de entre 5 y 12 años. Posteriormente puede cambiarse muy fácilmente gracias a la estandarización (IS-1-standard) de las conexiones de los electrodos.
Los nuevos marcapasos tienen además otras funciones:
- Sincronización, por un problema de comunicación, entre la aurícula y el ventrículo
- Modificación de la frecuencia de los latidos para adecuarse a actividad corporal del portador (marcapasos de frecuencia adaptativa)
- Ayuda a evitar problemas de ritmo de la aurícula mediante sobreestimulación (paso preventivo).
- Grabación o seguimiento de las perturbaciones del ritmo cardiaco.
- Mejora de la función de bombeo del corazón mediante una estimulación del ventrículo izquierdo o de ambos en caso de un mal funcionamiento del ventrículo izquierdo y falta de riego (terapia de resincronización cardiaca).